Sumário para o blogonauta
1. Big Bang (Sumário)
2. História milenar (Mitos da criação e começo da ciência com os gregos)
3. Modelo geocêntrico e o aperfeiçoamento do Telescópio
4. Teólogos, filósofos, poetas e astrónomos em debate
5. Máquina do Mundo (Lusíadas, Canto X)
6. Descobrimentos e a "ciência" (1)
7. Descobrimentos e a "ciência" (2)
8. Descobrimentos e a "ciência" (3)
9. Os Lusíadas: significado da epopeia
10. As "contra-epopeias"
11. A caminho do modelo heliocêntrico
12. O génio do "método experimental" (Tycho Brahe e Kepler)
12A. O génio do "método experimental" (Tycho Brahe e Kepler)
13. O génio do "modelo experimental" (Galileu) – Descobertas
14. Caso Galileu (1)
15. Caso Galileu (2)
16. A caminho das estrelas
17. Primeiras medições astronómicas
18. Desafio das Nebulosas
19. Medição das distâncias: Descoberta das Cefeidas
20. Medição das distâncias: a Fotografia entra em cena
21. Medição das distâncias: Cefeidas como Padrão de Medida
22. Interregno: Mini-Guiness sobre as Estrelas
23. História da Luz: Olho
24. História da Luz
24. História da Luz
25. Luz e Espectroscopia
26. Medição das velocidades das galáxias (Efeito de Doppler)
27. Lei de Hubble
28. Modelos teóricos, que partem todos da Teoria da Relatividade
29. Modelo de Einstein
30. Modelo de Friedmann-Lemaître.
Como não podemos (ainda ir) às galáxias nem às estrelas, foi necessário inventar um meio para poder determinar as suas características: composição química, velocidade, etc.. Esse método consiste apenas em olhar. Mas para olhar, já que os nossos olhos são tão limitados, exige-se uma aparelhagem muito sofisticada, que explora todas as informações que são transportadas num raio de luz. É aqui que entra a Espectroscopia, que como imaginarão, estuda o espectro, o espectro electromagnético de que falámos muito por alto e que assenta na teoria electromagnética elaborada por Maxwell.
Já sabemos que a luz Visível é uma pequeníssima parte do espectro, pois dele fazem parte as ondas Rádio, nas múltiplas aplicações, IV (radiação Infravermelha), Visível, UV (radiação Ultravioleta), Raios gama.
Mas precisamos de perceber qual é a natureza da luz e como se comporta.
ONDA DE LUZ
Os cientistas descrevem a luz como uma oscilação (vibração) dos campos eléctricos e magnéticos, conhecidos, com já vimos, por campo, espectro ou radiação electromagnética.
Mais tarde, se e quando vier a propósito, veremos que a Mecânica Quântica veio baralhar as coisas, introduzindo conceitos novos como o de “onda-partícula”. Mas a nível do nosso quotidiano, a luz comporta-se como uma onda.
Façamos uma comparação com as ondas de um lago.
Verificamos nelas quatro características:
- têm uma certa altura (amplitude);
- com um determinado número de ondas a passar num determinado tempo (frequência);
- na luz o tempo virá em segundos), movendo-se a uma certa velocidade (velocidade de onda) e, se estivermos com mais atenção, veremos ainda que há
- uma distância mais ou menos constante entre as cristas de duas ondas sucessivas (comprimento de onda).
ESPECTRO ELECTROMAGNÉTICO
Passemos agora para a “luz” ou espectro electromagnético. Estamos a pisar terreno muito escorregadio, mas… vejamos o que sai.
Os exemplos quotidianos mostram que a luz é uma forma de energia em propagação. Na verdade, a luz propaga-se na forma de ondas e as diferentes cores reflectem variações nas propriedades destas ondas.
Quando falamos do lago, o que oscila é a água; quando falamos do som, o que oscila (embora longitudinalmente: compressão / descompressão) é o ar. Mas quando falamos da luz, o que é que oscila? Antigamente dizia-se que era o éter; mas esse não existe. É uma onda que se propaga no vácuo. Mas como pode o vácuo ser perturbado?
Bom, deixemos estas coisas que têm a ver com "campos", conceito a que voltarei na altura própria.
Em 1900, Max Planck (1858-1947) apresentou o modelo da quantização da luz, segundo o qual a matéria emite luz em pacotes de energia, que ele denominou quanta (plural de quantum).
Vamos, portanto, descrever a luz como uma onda, que, já sabemos, se desloca à velocidade c = 300 000 km/s, como demonstrou Maxwell.
Mas a característica fundamental é o seu comprimento de onda (λ), porque nos diz praticamente tudo o que precisamos de saber sobre a onda, concretamente a cor e a energia.
COR
A cada comprimento de onda corresponde sempre uma e uma só cor, visível ou não. Por exemplo, se nos chegar aos olhos uma onda com um λ de 700 nm nós vemos uma cor vermelha, mas se for de 450 nm, já vemos uma cor azul.
Espectro visível: em comprimentos de onda e em cores
Deste esquema, facilmente concluímos que não existe uma cor vermelha, mas uma zona vermelha, na qual se vai passando da tonalidade mais “carregada” para a mais suave. E o mesmo acontece com as outras cores.
É esta a razão pela qual se prefere falar de λ e não de cores. Efectivamente há milhares de cores, numa graduação “contínua” entre o vermelho e o azul ou violeta, que o olho humano pode distinguir, como se mostra no chamado círculo cromático.
no qual estão dispostas todas as variações do espectro visível (todas as cores visíveis) para os humanos.
ENERGIA
Para as suas observações e cálculos, os (astro)físicos preferem a “energia de uma onda”, pois a luz é uma forma de energia.
A energia de uma onda luminosa é dada pela lei de Planck, através da frequência (ν)
E = h ν
onde h é a constante de Planck, uma quantidade extremamente pequena:
6,6 x 10-27 (ou 0,000 000 000 000 000 000 000 000 0066) erg.s.
Mas é muito fácil determinar a frequência a partir do comprimento de onda, pois estas duas grandezas estão intimamente relacionadas (inversamente: quando um cresce, a outra diminui): o seu produto é igual à velocidade da luz
c = λ ν
velocidade da luz = comprimento de onda vezes frequência da onda.
Desta simples expressão matemática, conclui-se imediatamente que uma onda de luz tem tanto mais energia quanto maior for a sua frequência ou menor o comprimento de onda.
Para lá do Visível
Como vimos no post anterior, o espectro electromagnético tem uma grande extensão, com um número ilimitado de comprimentos de onda que se manifestam em diferentes “cores”, das quais nós só vemos uma pequena parte: a zona visível.
No gráfico superior vemos a infinidade de comprimentos de onda que formam o espectro electromagnético (EE): quanto mais pequeno é o comprimento de onda (λ) (maior a frequência (ν)) maior a quantidade de energia transportada: os raios γ (gama) são os mais energéticos de todos;
No gráfico do meio, temos as várias zonas em que se divide o EE, com destaque para a zona Visível;
as frequências, aqui em sentido decrescente, medem-se em hertz, nº de ondas por segundo;
No gráfico do meio, temos as várias zonas em que se divide o EE, com destaque para a zona Visível;
as frequências, aqui em sentido decrescente, medem-se em hertz, nº de ondas por segundo;
os comprimentos de onda, em sentido crescente, estão medidos em metros.
Sendo assim, facilmente se percebe que, se a cada tipo de “luz” compreendem vários comprimentos de onda (por exemplo, a luz visível inclui comprimentos de onda entre 400 e 700 nm), são necessários telescópios diferentes para diferentes tipos de “luz”. Porque cada um desses instrumentos fornece diferentes informações, os astrónomos têm de estudar qualquer objecto celeste nos vários “espectros”, para o que devem dispor de instrumentos específicos para cada zona do espectro electromagnético.
LUZ POLARIZADA
É o somatório destas diferentes informações que lhes permite ter imagem coerente do Universo.
LUZ POLARIZADA
Este é um conceito também muito importante. Já vimos que o campo electromagnético é uma oscilação de dois campos perpendiculares (que fazem entre si um ângulo de 90º).
Vamos supor que há um único átomo a emitir uma radiação com uma energia específica e que nós estamos no caminho dessa emissão. Neste caso, o que veríamos em termos de campos oscilantes está representado na parte esquerda do esquema abaixo: E, o plano de oscilação do campo eléctrico; B, o do magnético (a). Como os planos de oscilação não variam, falamos em luz polarizada.
Os óculos polaróides só deixam passar luz polarizada numa determinada direcção eliminando a luz polarizada em outras direcções, evitando o encadeamento.
UM POUCO DE HISTÓRIA
De um modo geral pode observar-se três tipos de espectros:
1) Contínuo, quando a luz se apresenta como um contínuo de cores sem fronteiras delimitadas;
2) Discreto, que se caracteriza por riscas brilhantes (espectros de Emissão) ou por riscas escuras (espectros de Absorção).
Mas como se chegou a esta conclusão e que lições se podem tirar?
Podemos definir um espectro como um registo da radiação electromagnética nas sua várias "bandas".
Como já vimos no último post, Newton, em 1665, demonstrou que a luz branca, ao passar por um prisma de vidro, se decompõe em diferentes cores, formando um espectro com as cores do arco-íris.
Contudo, é bom recordar que já no século XVI, o alquimista L. Thurneysser (1531-1596) se tinha apercebido de que várias substâncias submetidas a uma chama produziam cores diferentes características.
Em 1752, Thomas Melvill inventou o “teste da chama”: submetia uma substância a uma chama e observava-a através de um prisma. Ao analisar as chamas coloridas de vários sais, verificou que uma risca amarela aparecia sempre na mesma posição do espectro, concluindo que deveria resultar de impurezas de Sódio existentes em todos esses sais.
Em 1758, A.S. Marggraf (1709-1782) confirmava as cores que os sais de sólido e de potássio conferiam à chama.
Em 1802, William Wollaston (1766-1828) observou, ao examinar a chama de uma vela através de um prisma, bandas descontínuas. E, nesse mesmo ano, resolveu repetir a experiência de Newton, mas com uma inovação: utilizou uma fenda estreita em vez da abertura circular. Verificou que no alvo, depois do prisma, aparecia um conjunto de riscas (ou linhas) escuras espalhadas pelo espectro colorido contínuo.
Espectro de Absorção do Sol (Wolloston)
Joseph Fraunhofer, em 1814, construiu um finíssimo prisma, com o qual detectou as riscas escuras do espectro solar. Por isso, há quem lhe atribua a descoberta do espectroscópio, mas talvez seja mais apropriado falar de um prisma espectroscópico.
Entretanto para aumentar resolução dos espectros, resolveu colocar uma lente convexa entre a fenda e o prisma.
Assim, em 1820, já tinha observado mais de 570 riscas no espectro solar. Classificou 324 por meio das letras do alfabeto: às mais fortes atribuiu letras maiúsculas e às mais fracas letras minúsculas, começando pelo lado do vermelho. Estas riscas ficaram conhecidas por "riscas de Fraunhofer".
Hoje sabe-se que nem todas as riscas têm a sua origem no Sol, como as riscas A e B.
Com a introdução das “redes de difracção”, que vieram eliminar efeitos de distorção do prisma que desviava mais as radiações violetas do que as vermelhas, foi possível, em 1862, catalogar cerca de 3000 riscas solares. Aqui fica uma pequena zona, dentro do Visível, situada entre os 430 e 440 nm.
Mas a grande dificuldade é que não sabia o que originava estas riscas. Para confirmar que o fenómeno não era específico do Sol, Fraunhoffer apontou o seu espectroscópio para as estrelas Sirius, Castor, Pollux, Capella, Betelgeuse e Procyon e observou também riscas escuras nos seus espectros.
O Angstrom (Aº) vale 0, 000 000 000 01 m;
outra unidade muito utilizada é o nm, nanómetro, dez vezes maior.
outra unidade muito utilizada é o nm, nanómetro, dez vezes maior.
Mas a grande dificuldade é que não sabia o que originava estas riscas. Para confirmar que o fenómeno não era específico do Sol, Fraunhoffer apontou o seu espectroscópio para as estrelas Sirius, Castor, Pollux, Capella, Betelgeuse e Procyon e observou também riscas escuras nos seus espectros.
Em 1822, John Herschel (1792-1871), filho de William Herschel, verificou que as chamas coloridas, obtidas na combustão de determinadas substâncias, emitiam padrões bem definidos de linhas espectrais, concluindo que era possível identificar as substâncias, mesmo em quantidades diminutas, pela simples observação do espectro produzido pela sua chama.
NASCIMENTO DA VERDADEIRA ESPECTROSCOPIA
O grande salto qualitativo surgiu com duas grandes descobertas: a invenção do espectroscópio e a elaboração das leis de Kirchhoff.
Espectroscópio
Esta invenção foi precedida por outra não menos importante, em 1856: a do bico de Bunsen, muito utilizado nos laboratórios científicos porque tem uma chama incolor. Isto é, quando se vaporiza algum material no bico de Bunsen, a cor emitida é a da própria substância e não a da chama do bico.
G.R. Kirchhoff (1824-1887), colaborador de Bunsen, sugeriu-lhe que a cor da chama vaporizada no bico de gás seria melhor observada se passa-se através de um conjunto de lentes e um prisma. Assim, surgiu, em 1859, um instrumento novo, o espectroscópio, com o qual se podiam obter as riscas espectroscópicas com grande precisão.
Legenda do "Esquema": 1 - Chama; 2 - Colimador; 3 - Prisma; 4 - Telescópio; 5 - Plataforma de suporte.
A explicação do que é cada parte do aparelho - A, B, C, D, E, F, G e H - é feita numa "Memória" escrita pelos inventores.
Para a construção do espectroscópio, os dois tinham motivações diferentes: Bunsen queria interpretar a cor dada à chama pelos diferentes sais; Kirchhoff, as riscas de Fraunhoffer.
Como mero apontamento histórico, acrescentarei que o Laboratório Químico da Universidade de Coimbra foi um dos primeiros compradores deste espectroscópio (“espectrómetro”) cinco anos depois do seu aparecimento.
Após muitas observações, Kirchhoff e Bunsen concluíram que cada elemento químico produzia riscas específicas, o que significava que, visto através do prisma, cada elemento tinha uma assinatura própria, inconfundível. Demonstraram também que as linhas características de cada elemento não eram afectadas pela presença de outros elementos e que bastava uma quantidade diminuta do elemento para produzir o seu espectro. Como vimos, Herschel já tinha chegado à mesma conclusão quarenta anos antes!
Com o espectroscópio passou a dispor-se de um potente método, com uma sensibilidade nunca antes atingida, para detectar a presença de elementos desconhecidos em minerais.
Facilmente concluímos que o Sol não tem nem Lítio nem Mercúrio, pois as riscas destes dois metais não existem no espectro solar.
Bunsen e Kirchhoff descobriram dois novos metais alcalinos:
- o césio (1860), com “uma formosa cor azul”, pelo lhe deram este nome derivado do latim caesius, palavra com que “os antigos designavam o azul da parte superior do firmamento” e
- o rubídio (1861), “de rubidus que entre os antigos servia para designar o vermelho mais intenso”.
Foram os primeiros a mostrar que, estando as duas riscas D (D1 e D2) do espectro solar estão exactamente na posição das riscas do Sódio, este metal deve existir na cromosfera solar.
Este avanço favoreceu muito a observação e análise dos espectros de um número muito elevado de estrelas, em diferentes estádios de evolução, permitindo com estes dados e o conhecimento das temperaturas das estrelas, as primeiras hipóteses sobre a evolução estelar.
Assistiu-se, então, a uma verdadeira caça aos espectros estelares, o que obrigou a proceder a uma classificação dos espectros, assunto que não abordarei aqui. Actualmente os principais tipos espectrais são: no visível: O, B, A, F, G, K e M; para lá do azul: W; para lá do vermelho: S e C. Alguns destes tipos estão ainda subdivididos.
Leis de Kirchhof
Mas voltando às riscas observadas por Kirchhoff e Bunsen havia um problema: eram brilhantes, ao contrário das linhas observadas por Fraunhofer, que eram escuras.
Terceiro: Depois de várias experiências, concluíram que o Sol só podia ser formado por de gás ou por um sólido quente envolto por um gás mais frio.
Quarto: Kirchhoff, depois de muitas experiências, acabou por formular as três leis básicas da espectroscopia, as chamadas Leis de Kirchhoff:
1ª - Um corpo opaco quente, sólido, líquido ou gasoso, produz um espectro contínuo.
2ª - Um gás quente produz um espectro de riscas brilhantes (“riscas de emissão”) correspondentes unicamente aos elementos químicos presentes no gás.
3ª - Se a luz de um corpo (que produz espectro contínuo, conforme a 1ª lei) passar por um gás mais frio, aparecem riscas escuras (“riscas de absorção"), correspondentes unicamente aos elementos químicos presentes no gás.
MAS… COMO SURGEM AS RISCAS?
A primeira explicação destas riscas foi obtida empiricamente por Balmer e apresentada numa conferência em Basileia, a 25.Junho.1884. Ele representou os comprimentos de onda das quatro linhas visíveis do espectro de Hidrogénio em termos de um número arbitrário h (lado esquerdo superior da imagem) e reconheceu que podia rescrevê-las de tal modo (lado esquerdo inferior do esquema) que os numeradores formavam uma sequência 32, 42, 52 e 62 e que os denominadores também se apresentavam como uma outra sequência 32 - 22, 42 - 22, 52 - 22 e 62 - 22. Tanto o numerador como o denominador podem ser escritos de forma condensada como n2 e n2 - 22, com n > 2.
E assim chegamos à fórmula de Balmer (lado direito superior da imagem), que explicas as quatro riscas visíveis do espectro de Hidrogénio, por isso mesmo chamada a série de Balmer.
Repare-se que o espectro do Hidrogénio pode exprimir-se em termos de 2 números inteiros: n e 2. Ou melhor, SÓ PODE EXPRIMIR-SE POR MEIO DE UMA FÓRMULA QUE APENAS CONTÉM NÚMEROS INTEIROS. Destaco isto, porque mais à frente, veremos a revolucionária importância deste facto quando falarmos de Quantização.
Balmer mostrou que esta fórmula se podia generalizar e aplicar às 12 riscas, então, conhecidas, no espectro do Hidrogénio, com um erro de 0,1 Å. Havia, no entanto, uma excepção de uma, cujo desvio era 4 Å, o que ele atribuiu a erros de medição mas não à sua fórmula.
Em 1890, Rydberg descobriu uma fórmula (lado direito inferior do esquema), que explicava não só o espectro do hidrogénio mas também o dos metais alcalinos e mostrou que a fórmula de Balmer era um caso particular desta lei geral
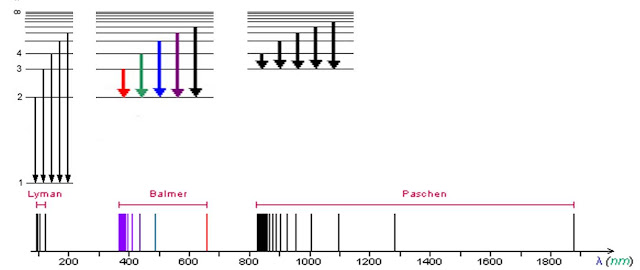
- no caso do H, fazendo nf (órbita final para a qual decai o electrão excitado vindo de qualquer outra órbita ni) igual a 1, temos a série de Lyman; a 2, a nossa conhecida série de Balmer; a 3, a série de Paschen; etc. (como veremos mais à frente);
- no caso dos metais alcalinos, o que muda é o valor de R, a chamada constante de Rydberg, que para o caso do H, é igual a 1, 097 373 156 8525 x 10-7 m-1. Se deixo aqui este valor é porque esta constante é considerada uma das mais bem definidas constantes da Física, com um erro experimental de menos de 7 partes num milhão de milhões (1012).
Mas, não esqueça, estamos no campo empírico, para obter uma explicação fundamentada numa teoria e portanto mais consistente, teremos de fazer uma incursão prévia pela história do átomo, pois é neles que encontraremos a explicação para as riscas espectrais.
Como já vimos várias vezes, alguns filósofos da Grécia Antiga já admitiam que toda e qualquer matéria era formada por minúsculas partículas invisíveis e indivisíveis, que foram denominadas átomos (“sem partes, indivisível”).
Em 1808, Dalton propôs uma teoria atómica, em que as partículas, em que o átomo é uma minúscula esfera maciça, impenetrável, indestrutível e indivisível, semelhante a uma bola de bilhar, o que lhe deu o nome o modelo atómico da bola de bilhar.
A matéria é constituída de diminutas partículas amontoadas como bolhas de bilhar.
No tempo de Dalton ainda só tinham sido descobertos 36 elementos químicos e, como é natural, muitos símbolos vinham da Alquimia. Outros foi o próprio Dalton que os inventou.
MODELO DE THOMSON – PUDIM DE PASSAS
Em 1903, J. J. Thomson, o descobridor do electrão, baseando-se em experiências realizadas com gases e que mostraram que a matéria era formada por cargas eléctricas positivas e negativas, propôs que o átomo seria uma esfera maciça com as cargas positivas e negativas iguais, pois o átomo seria electricamente neutro, formando uma espécie de sopa com dois ingredientes.
No tempo de Dalton ainda só tinham sido descobertos 36 elementos químicos e, como é natural, muitos símbolos vinham da Alquimia. Outros foi o próprio Dalton que os inventou.
MODELO DE THOMSON – PUDIM DE PASSAS
No tempo de Dalton ainda só tinham sido descobertos 36 elementos químicos e, como é natural, muitos símbolos vinham da Alquimia. Outros foi o próprio Dalton que os inventou.
Em 1903, J. J. Thomson, o descobridor do electrão, baseando-se em experiências realizadas com gases e que mostraram que a matéria era formada por cargas eléctricas positivas e negativas, propôs que o átomo seria uma esfera maciça com as cargas positivas e negativas iguais, pois o átomo seria electricamente neutro, formando uma espécie de sopa com dois ingredientes.
MODELO DE RUTHERFORD
Em 1911, Ernest Rutherford (1871-1937) e os seus colaboradores (Hans Geiger (1882-1945) e Ernest Marsden (1889-1970)), quando bombardeavam uma lâmina de ouro com partículas α (que são núcleos de Hélio, formado de 2 protões e 2 nucleões), verificaram que a esmagadora maioria das partículas α atravessava a lâmina de ouro: só 1 em 10 000 sofria um desvio ou era repelida.
MODELO DE RUTHERFORD
Em 1911, Ernest Rutherford (1871-1937) e os seus colaboradores (Hans Geiger (1882-1945) e Ernest Marsden (1889-1970)), quando bombardeavam uma lâmina de ouro com partículas α (que são núcleos de Hélio, formado de 2 protões e 2 nucleões), verificaram que a esmagadora maioria das partículas α atravessava a lâmina de ouro: só 1 em 10 000 sofria um desvio ou era repelida.
Daqui tiraram uma primeira conclusão: o raio de um átomo poderia ser cerca de 10 000 vezes maior que o do seu núcleo. O que significava que o átomo era constituído por pequeníssimo núcleo, com carga eléctrica positiva, rodeado por uma nuvem de electrões (Primeira versão do esquema abaixo).
Era por esses espaços vazios que a grande maioria das partículas α atravessava a lâmina de ouro. Os desvios sofridos eram devidos às repulsões eléctricas entre o núcleo (positivo) e as partículas α, também positivas, que com ele chocavam, já que cargas eléctricas do mesmo sinal repelem-se (lei de Coulomb).
Aqui surgia uma dificuldade grave. Pela mesma lei de Coulomb, cargas eléctricas de sinal contrário atraem-se, pelo que os electrões deviam rapidamente cair no núcleo. Mas se isso ocorresse todos os átomos seriam instáveis e não poderia haver matéria. Mas ela existe. Nós somos matéria.
Só havia uma solução: eram os electrões girarem em torno do núcleo tal como os planetas em torno do Sol (Segunda versão do esquema).
Tudo simples, não fosse outra dificuldade, esta verdadeiramente intransponível: contrariamente aos planetas, as cargas eléctricas em movimento circular emitem energia; ao perder energia são mais atraídas debilmente, entrando numa espiral, acabando por cair no núcleo (Imagem do lado direito do esquema). E voltamos à situação anterior: os átomos não podem ser estáveis.
Esta dificuldade veio provar (embora outros fenómenos apontasse no mesmo sentido como o efeito fotoeléctrico ou a radiação do corpo negro) que as leis da mecânica clássica não se aplicavam a corpos microscópicos como os átomos. Está aqui o embrião donde surgirá a Mecânica Quântica.
MODELO DE BOHR
- na electrosfera, os electrões não se encontram em qualquer posição: giram ao redor do núcleo em órbitas, fixas e com energia bem definida, chamadas camadas electrónicas, representadas pelas letras K, L, M, N, O, P e Q a partir do núcleo, ou níveis de energia representados pelos números 1, 2, 3, 4...
- os electrões ocupam as camadas mais próximas do núcleo, porque são as menos energéticas;
- os electrões ao movimentarem-se na sua camada, não absorvem nem emitem energia;
- quando um átomo recebe energia, o electrão pode saltar para uma camada mais externa (mais energética): o átomo fica instável, ficando num estado excitado;
- os electrões de um átomo excitado tendem a voltar para as camadas de origem, emitindo a energia recebida.
Este modelo ficou conhecido como modelo planetário, pela sua semelhança com a formação do Sistema Solar.
Modelo atómico de Bohr (átomo de Alumínio)
Este modelo está hoje ultrapassado pelo modelo quântico (no qual as camadas orbitais bem definidas dos electrões foram substituídas por zonas de probabilidade electrónica, chamadas orbitais, o electrão é considerado onda-partícula, etc. e tal), mas serve para explicar por que razão existem riscas espectrais, que é o que nos interessa.
QUANTIZAÇÃO
Agora estamos prontos para perceber por que aparecem riscas nos espectros.
Voltemos ao modelo do átomo de Bohr. Já sabemos que os electrões só podem girar em determinadas órbitas.
Suponhamos o átomo maia simples: o do Hidrogénio, que tem apenas um electrão.
O Hidrogénio, à temperatura ordinária, estão no que se chama o estado fundamental (n = 1), isto é, o electrão ocupa a órbita mais próxima do núcleo. Este é o seu estado normal. Mas pode suceder-lhe um percalço e receber energia. Para onde vai ela? Se for suficiente, vai empurrar o electrão para uma órbita superior. E fica num estado excitado (n > 1). Ou até pode "expulsar" o electrão do átomo, e, neste caso o átomo fica ionizado, isto é, deixa de ser neutro e torna-se um ião, com a carga +1. Essa energia suficiente para expulsar o electrão é típica de cada átomo e chama-se energia de ionização.
Quando recebe energia, o átomo passa do estado normal a um estado excitado ou ionizado.
Contudo, nenhum átomo se mantém naturalmente no estado excitado. Portanto, rapidamente volta ao estado fundamental. Como? Libertando a energia que recebera e voltando ao estado normal (n = 1).
Agora vamos recordar aquela "idiotice" de Bohr, ao postular que nem todas as órbitas são permitidas. Ora se só algumas são permitidas, isso significa que o electrão só pode receber determinadas quantidades de energias e não todas. A isto chama-se quantização. Significa que não há um valor contínuo de energias que possam ser recebidas ou emitidas, mas só algumas (valores discretos).
Continuemos no átomo de Hidrogénio. Fazendo os cálculos, sabemos quanto "vale" cada órbita.
Várias órbitas excitadas e as energias necessárias para fazer "saltar" o electrão.
Repare-se que as diferenças de energias entre as várias órbitas "excitadas" vêm expressas em nm (comprimentos de onda), mas já sabemos fazer essas conversões de unidades.
Já começamos a ver onde tudo isto nos vai levar. Voltemos ao Hidrogénio.
Quando um átomo recebe a energia adequada, ele "excita-se", promovendo um electrão a uma órbita superior. E o que se passa, então? À luz (energia) incidente vai ser roubada uma "cor", precisamente aquela que forneceu a energia para o electrão saltar. Assim obtemos a risca preta no ponto do espectro onde deveria estar aquela "cor" correspondente à energia absorvida (roubada à radiação incidente). Chama-se-lhe espectro de Absorção (ver atrás nas Leis de Kirchhoff) porque resulta da absorção de energia.
É por este processo que se obtém o espectro de absorção do Hidrogénio. Se a luz emissor for composta por vários comprimentos de onda, então todo o espectro de absorção aparece. Por exemplo, uma estrela, que emite milhares de "cores" (1*).
No caso do espectro de Emissão, o processo é um pouco mais complicado, porque tem de passar por duas fases: primeiro, os electrões devem ser excitados; depois, ao decaírem emitem eles próprios uma radiação que têm de ter exactamente a mesma energia (comprimento de onda) que as riscas negras do espectro de Absorção. Imaginemos uma situação análoga à anterior. A "luz" da estrela excita os electrões. Então, naturalmente, eles tendem a cair para as órbitas mais baixas e ao fazê-lo emitem agora as riscas respectivas.
Resumindo num único gráfico para verificarmos a coincidência da localização das "riscas":
Como os espectros de emissão e de absorção do mesmo elemento são "complementares", isto é, as riscas têm o mesmo comprimento de onda, se os "somarmos", obteremos um espectro contínuo, pois as riscas brilhantes da emissão "apagam" as riscas negras da absorção.
Portanto, como os electrões "excitados" podem ocupar todas as órbitas disponíveis, ao voltarem ao estado fundamental vão dar origem a uma série de emissões muito precisas, que originam riscas no espectro, conhecidas por "séries".
Como os espectros de emissão e de absorção do mesmo elemento são "complementares", isto é, as riscas têm o mesmo comprimento de onda, se os "somarmos", obteremos um espectro contínuo, pois as riscas brilhantes da emissão "apagam" as riscas negras da absorção.
"Soma" dos espectros de emissão e de absorção dá um espectro contínuo
Não é tão complicado como parece.
Na parte supeior, vemos electrões que forma excitados a decair para o nível fundamental ou normal, dando origem à chamada série de Lyman, que "emite" no UV, invisível para os nossos olhos; depois, vemos electrões excitados a decair para o n = 2 (série de Balmer) e, na seguinte, o electrões caem para n = 3 (série Paschen) que emite no IV, também numa banda invisível para nós. Há ainda outras séries.
ASTROFÍSICA
Embora, na altura não se soubesse a causa das riscas espectrais, rapidamente começou a caça aos espectros, como já referi.
Fundamental para os astrónomos é que as estrelas emitem ondas luminosas. Também já sabemos que cada elemento emite sempre o mesmo espectro, que é uma espécie de impressão digital ou o seu DNA: não há dois iguais. Assim sendo bastaria analisar os espectros das estrelas para saber de que elementos químicos era ela constituída.
Fonte: Big Bang (Simon Sing), p. 267
O sexto espectro de uma gás desconhecido que, comparando-o com os outros, torna-se claro que certamente não contém nem Hélio nem Sódio.
Descobrimento do Hélio
Esta técnica revelou-se tão poderosa que levou à descoberta, no Sol, de um elemento químico, que era desconhecido na Terra.
Em 1868, um espectroscópio foi usado pela primeira vez, por Jansen, no estudo da cromosfera solar durante um eclipse total, em Guntur (Índia), uma zona onde o eclipse total podia ser observado durante mais tempo, cerca de 5 minutos. O espectro obtido continha muitas riscas brilhantes, entre as quais se encontravam as do hidrogénio e uma, amarela (λ = 587,49 nm), que se julgava ser a risca amarela do sódio. Contudo, Janssen, desconfiado, resolveu investigar melhor aquela risca e tentou obter o espectro da cromosfera com a luz solar ordinária, conseguindo provar que não se tratava do sódio, mas provavelmente de um novo elemento.
Em cima: o espectro do Hélio com a célebre risca amarela.
No meio: os espectros comparados do Hélio e do Sódio.
Em baixo: uma brincadeira minha em que ampliei ao máximo (permitido pelo espaço disponível) as riscas amarelas: a do He e as duas do Na: a distância real entre as duas riscas extremas é de apenas 0,2 nm, ou seja, 0, 000 000 002 m. Admire-se, primeiro, a intuição de Janssen de que não se trataria do Sódio; segundo, o poder de resolução entretanto conseguida pelos inventores!
Lockyer e Frankland confirmaram estes resultados e provaram que aquela risca amarela não poderia ser obtida de nenhum elemento terrestre conhecido. Por isso, Frankland propôs o nome de "hélio", do nome do deus grego do Sol.
Esta risca foi mais tarde detectada no espectro de outras estrelas.
Embora Palmieri, em 1822, a tenha observado nos gases libertados pelo Vesúvio, não se conseguia encontrar tal elemento, até que, em 1895, William Ramsay descobriu a tão procurada risca no gás, libertado pelo cleveite, um mineral radioactivo que se encontra na Noruega, ao ser tratado com ácidos.
Esta descoberta permite-me explicar de uma maneira muito simples por que razão os astrofísicos se servem dos espectros de absorção e não dos de emissão para estudar as estrelas e outros corpos celestes. O que Janssen observou durante o eclipse solar não foi ao Sol mas a sua "atmosfera".
Esta descoberta permite-me explicar de uma maneira muito simples por que razão os astrofísicos se servem dos espectros de absorção e não dos de emissão para estudar as estrelas e outros corpos celestes. O que Janssen observou durante o eclipse solar não foi ao Sol mas a sua "atmosfera".
Sol observado pelo satélite STEREO Eclipse total do Sol de Março de 2006
Então Janssen não captou a radiação luminosa emitida pela excitação dos electrões dos átomos do Sol (espectro de emissão), porque havia um eclipse total, que não permitia que a luz vinda directamente do Sol chegasse à Terra.
O que ele recebeu foi a luz solar que passou pela atmosfera do Sol (coroa). Então, como já vimos e se não se lembram vão ver a segunda lei de Kirchhoff lá mais em cima, a energia da luz solar é absorvida pelos electrões excitados da atmosfera, não deixando, portanto, passar os comprimentos de onda absorvidos e deixando no seu lugar as correspondentes riscas (espectro de absorção).
Ora a situação "normal" é a luz das estrelas passar pela sua atmosfera e portanto dar origem a espectros de emissão. Mas, convém não esquecer que os espectros de emissão e de absorção são "complementares" ou "invertidos", como vimos atrás. E, portanto, o facto de haver uma risca num dado ponto é porque antes de decair o electrão recebeu uma energia igual.
William e Margaret Huggins
W. Huggins (1824-1910), depois de vender o negócio de tecidos da família, pode construir um observatório em Upper Tulse, nos subúrbios de Londres. E quando soube das descobertas de Bunsen e Kirchhoff terá dito: “Estas notícias foram para mim como uma nascente de água numa terra árida e sedenta”. É então que, a partir da década de 1860, se lança num projecto ambicioso - o de cartografar o máximo de corpos celestes para poder determinar a sua composição - utilizando o espectroscópio e mais tarde a fotografia.
Começou por preparar o melhor possível o seu observatório, mas deparou-se logo com várias dificuldades: a luz das estrelas, mesmo as mais brilhantes, era muito débil para dar um espectro “legível”; as constantes mudanças de homogeneidade da atmosfera terrestre; e as riscas, que ia obtendo, eram tantas e tão próximas que se sentia perdido.
Foi então que, conjuntamente com W.A. Miller, desenvolveu, em 1862, o seu primeiro espectroscópio, “para ver as riscas nos espectros estelares com muito mais detalhe do que foi figurado ou descrito por qualquer observador anterior”
EspectrómetroHigginsMillerMEU
As estrelas, de cima para baixo, são: Aldebaran, Sirio, Betelgeuse e o Sol
Os espectros das estrelas Aldebaran e Betelgueuse, obtidos em 1964,revelaram-se de um enorme importância, pois eram tinham muito mais riscas, que Huggins identificou com comprimentos de onda correspondentes aos que eram absorvidos, nas experiências laboratoriais, pelo sódio, magnésio, cálcio, ferro e bismuto.
EspectroscopiaEspectrosestrelasAldebaraneBetelgeuseHugginseMiller(1864)
Esta descoberta não veio apenas pôr em causa a ideia antiga de que as estrelas eram compostas pelo que chamavam a “quinta-essência” (quinta, porque era diferente dos quatro elementos terrestres: ar, terra, fogo e água). Permitiu também a Huggins demonstrar que nelas existiam os mesmos elementos que na Terra e, extrapolando, propôs que possivelmente todo o Universo era formado pelos mesmos elementos químicos que a Terra. E, assim sendo, “demonstrou-se que a mesma química vigora em todo o universo”.
Esta era uma conclusão verdadeiramente incrível para a época.
Numa das suas visitas à fábrica Grubb para inspeccionar a construção de dois telescópios, conheceu a jovem Margaret Murray com quem casou em 1875: Huggins, com 51 anos e Margaret com 27. Em diferença de idades até se tornou muito positiva, pois quando William já não podia subir as escadas para a plataforma dos telescópios, foi Margaret que assumiu todas as tarefas. Aliás, ela fazia de tudo desde a limpeza dos aparelhos, que ela não entregava a ninguém dada a sensibilidade de tudo aquilo, até à construção de novos aparelhos e ensaios com novos produtos para placas fotográficas.
Numa das suas visitas à fábrica Grubb para inspeccionar a construção de dois telescópios, conheceu a jovem Margaret Murray com quem casou em 1875: Huggins, com 51 anos e Margaret com 27. Em diferença de idades até se tornou muito positiva, pois quando William já não podia subir as escadas para a plataforma dos telescópios, foi Margaret que assumiu todas as tarefas. Aliás, ela fazia de tudo desde a limpeza dos aparelhos, que ela não entregava a ninguém dada a sensibilidade de tudo aquilo, até à construção de novos aparelhos e ensaios com novos produtos para placas fotográficas.
EspectroscopiaMargaretHugginsMEU
Ela definiu-se como “I am a capital scientific housemaid” (Eu sou uma importante mulher a dias científica), porque escreveu ela: “Aqui, o trabalho pode ser de vários tipos. Pode ser fotográfico, caso em que eu tenho de ajudar na organização dos instrumentos, mantendo a luz alinhada, e assim por diante. Se estamos a trabalhar electricamente, então devo cuidar das baterias, fixar os eléctrodos. Posso também ter de misturar produtos químicos, purificando-os, pesando-os, dissolvendo-os, fervendo-os,… Quando há poeira, lavo os laboratórios, sem empregada, pois não são permitidas nestes recintos sagrados. Eu sou uma importante mulher a dias científica. Posso deixar o William mexer nos frascos, quando ele sabe onde encontrá-los”.
NOTAS
(1*) Não quero baralhar, mas uma observação para os mais curiosos. É precisamente porque a estrela emite em "todos" os comprimentos de onda que aparece aquele espectro contínuo sobre o qual se vão distribuindo as riscas. Mas fico-me por aqui.







































.jpg)
